Tryggja öryggi með því að bíða markaðsleyfis
„Bandaríska lyfjastofnunin er á svolítið öðrum tímalínum en Evrópska lyfjastofnunin. Þetta er ekki nákvæmlega saman ferlið. Það er ekki sótt í sömu ferlana og slíkt,“ segir Rúna.
AFP
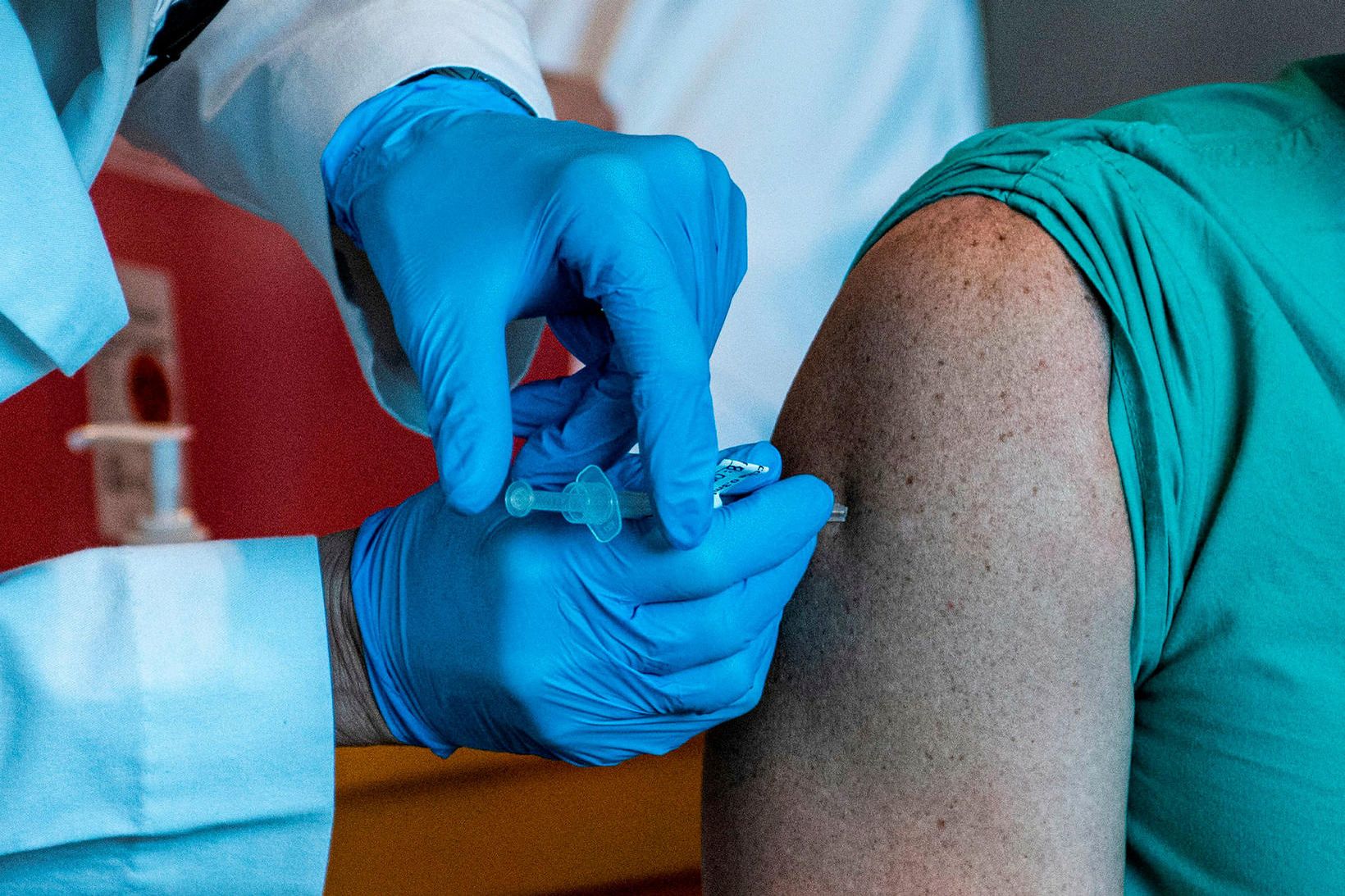
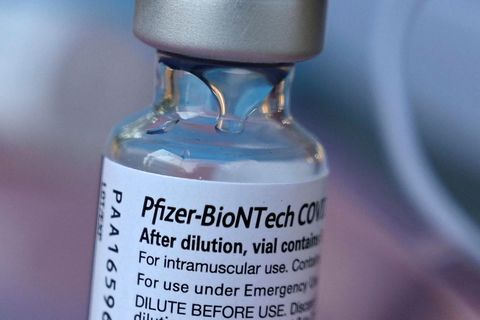
Lagalega séð hefði Ísland getað farið sömu leið og Bretar og gefið út bráðaleyfi fyrir bóluefni Pfizer/BioNTech en forstjóri Lyfjastofnunar segir að ákvörðun hafi verið tekin um að bíða eftir fullu markaðsleyfi þar sem með því verði öll gögn yfirfarin og gæði og öryggi bóluefnisins tryggð.
Fleiri bóluefni eru nú í svokölluðu áfangamati hjá Lyfjastofnun Evrópu en það er flýtimeðferð sem felst í því að erindi þeirra eru afgreidd á 70 dögum í stað 210 daga. Þannig ætlar stofnunin t.a.m. að taka ákvörðun um markaðsleyfi fyrir lyfjafyrirtækið Moderna fyrir 12. janúar næstkomandi.
„[Áfangamatið] byggir á því að fyrirtækin geta skilað inn gögnum jafnóðum. Yfirleitt er það þannig að fyrirtækin klára allt hjá sér og skila síðan bara skráningargögnunum eins og þau liggja fyrir en þetta er leið sem Evrópska lyfjastofnunin hefur til þess að bregðast við heilbrigðisvá sem við stöndum klárlega frammi fyrir núna. Svoleiðis að öllum ferlum upp á að skila gögnum var flýtt en engu var flýtt í matinu sjálfu,“ segir Rúna Hauksdóttir Hvannberg, forstjóri Lyfjastofnunar Íslands.
Útlit fyrir að markmiðið náist
Lyfjastofnun Evrópu gaf það út í dag að ákvörðun um markaðsleyfi bóluefnis Pfizer/BioNTech yrði tekin 21. desember næstkomandi, rúmri viku en áður hafði verið áætlað. Rúna segir að núna sé útlit fyrir að það takist. Fulltrúar Lyfjastofnunar Íslands sitja í sérfræðinganefndum Lyfjastofnunar Evrópu sem leggur mat á bóluefnið.
Bretar, Bandaríkjamenn og fleiri hafa nú þegar samþykkt bóluefnið og hafið bólusetningu.
Hvers vegna tekur þetta lengri tíma fyrir Lyfjastofnun Evrópu en Bandaríkin, Bretland og fleiri?
„Bandaríska lyfjastofnunin er á svolítið öðrum tímalínum en Evrópska lyfjastofnunin. Þetta er ekki nákvæmlega saman ferlið. Það er ekki sótt í sömu ferlana og slíkt. Hvað varðar Bretland þá heyra þeir enn undir evrópsku lyfjalöggjöfina, þeir gera það til loka þessa árs. Þeir ákváðu að veita svokallað bráðaleyfi þar sem þeir losa tvær lotur inn á breska markaðinn. Það er bara ákvörðun sem var tekin þar en það er eðlismunur á þessum leyfum,“ segir Rúna.
Bretar fengu undanþágu
Aðspurð segir hún að Ísland og önnur ríki í Evrópu hefðu lagalega séð getað beitt bráðabirgðaákvæðinu sem Bretar beittu og gefið út bráðaleyfi.
„Það er í sjálfu sér bara undanþága. Við ákváðum að gera það ekki og engin nágrannalanda okkar heldur. Við ákváðum að bíða eftir fullu markaðsleyfi [frá Lyfjastofnun Evrópu] þar sem búið er að fara yfir öll gögn sem tryggja gæði og öryggi lyfsins. Það er búið að spyrja þeirra spurninga sem sérfræðingarnir vilja spyrja,“ segir Rúna.
Hún bendir á að það hafi skipt Breta miklu máli að fá bóluefnið eins hratt og hægt var.
„Þeir hafa náttúrulega átt í mjög miklum erfiðleikum í faraldrinum og hafa ekki náð góðum tökum á skimun og slíku svo þetta skipti þá mjög miklu máli.“
Moderna og AstraZeneca metin von bráðar
Hvernig standa önnur bóluefni?
„Þau eru í þessu svokallaða áfangamati. Það sem Evrópska lyfjastofnunin hefur gefið út með Moderna er í síðasta lagi 12. janúar. Það gæti að sjálfsögðu færst framar. Svo er spurning um það hvar AstraZeneca bóluefnið stendur en það verður líklegast bara metið í kjölfarið enda eru það þessi bóluefni sem flest af Evrópuríkjunum hafa samið um kaup á og er beðið eftir með að bólusetja fólk.“
Lyfjastofnun Íslands undirbýr nú komu bóluefna til landsins. Til að mynda er nú unnið að því að þýða upplýsingar um lyfið fyrir heilbrigðisstarfsmenn og sjúklinga. Þá hugar Lyfjastofnun Íslands að ýmsum praktískum atriðum, eftirliti með flutningi á bóluefnunum og er í samstarfi við heilsugæsluna um framkvæmd bólusetninga.
Markaðsleyfi hérlendis vonandi gefið út á Þorláksmessu
Eftir að Lyfjastofnun Evrópu gefur út markaðsleyfi þarf Lyfjastofnun Íslands að gera slíkt hið sama svo nota megi bóluefnið hér á landi. Rúna segir að Lyfjastofnun Íslands muni gefa út markaðsleyfi fljótlega eftir að Lyfjastofnun Evrópu hefur gert það, til dæmis á Þorláksmessu.
Hvaða ferli fer þá í gang hjá ykkur?
„Matið er hjá Evrópsku lyfjastofnuninni. Þar eru okkar sérfræðingar svo þetta er mat hennar. Það sem við gerum er að setja íslensku textana inn í evrópska markaðsleyfið. Við erum í EES sem gefur út markaðsleyfið sirka degi á eftir Evrópsku lyfjastofnuninni. Svo fylgjum við og það er að mörgu leyti bara formsatriði.“






 Nýr gróðureldur blossar upp í Los Angeles
Nýr gróðureldur blossar upp í Los Angeles
 Hvað er Trump búinn að gera?
Hvað er Trump búinn að gera?
 „Þetta er ógnvænleg staða“
„Þetta er ógnvænleg staða“
 Gjöldum dembt á í blindni
Gjöldum dembt á í blindni
 Viðurkennir ábyrgð og segir af sér
Viðurkennir ábyrgð og segir af sér
 Bendir hveitifyrirtæki á kærumöguleika
Bendir hveitifyrirtæki á kærumöguleika
 Ekki tekist að vernda börn þrátt fyrir vitneskju
Ekki tekist að vernda börn þrátt fyrir vitneskju
 Egyptar sigraðir og Ísland í toppmálum
Egyptar sigraðir og Ísland í toppmálum