Mengaðir skammtar ekki í dreifingu á Íslandi
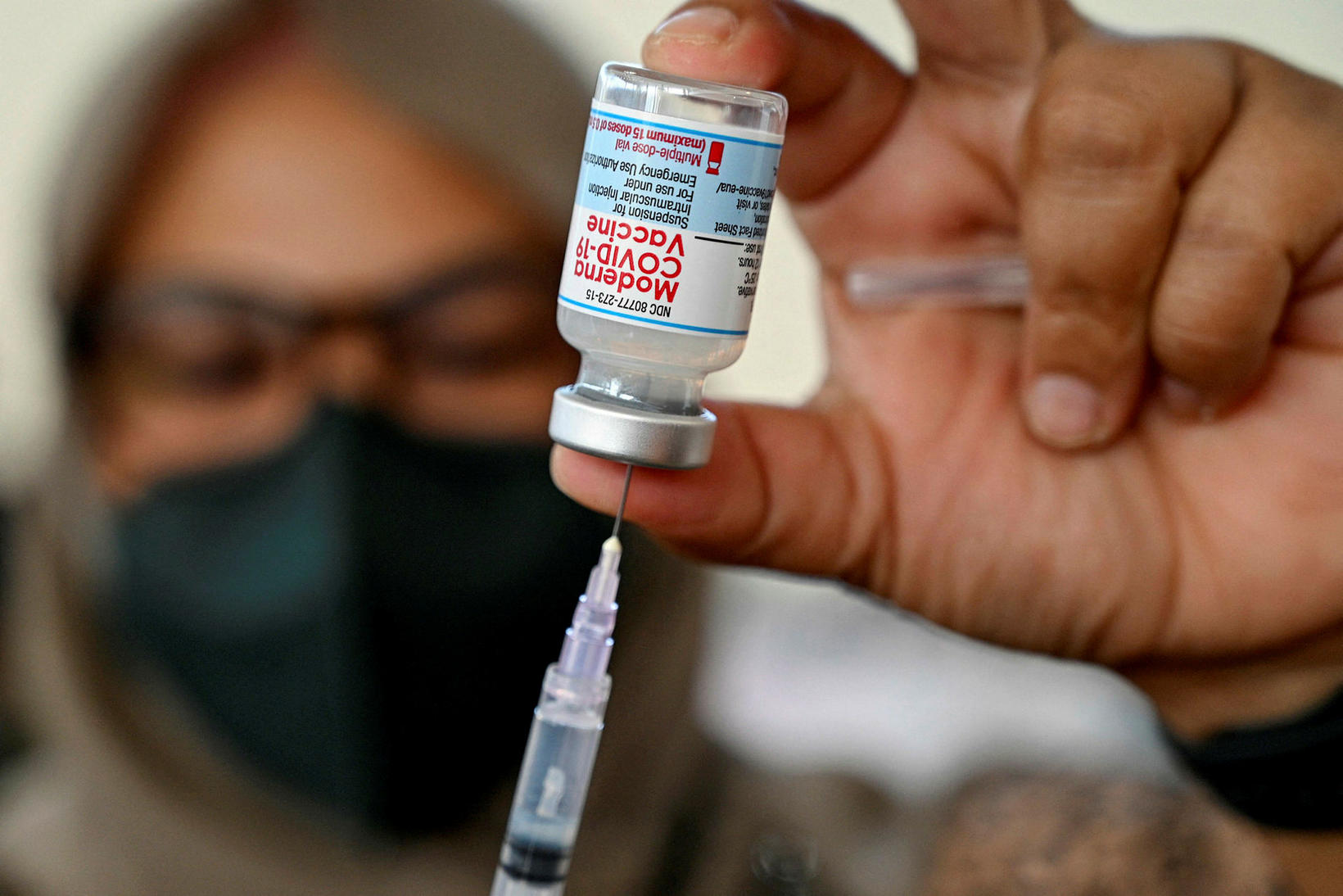
Lyfjastofnun hefur haft veður af málinu í Japan þar sem yfirvöld hættu notkun á 1,7 milljón skammta af bóluefni Moderna.
mbl.is/Hjörtur
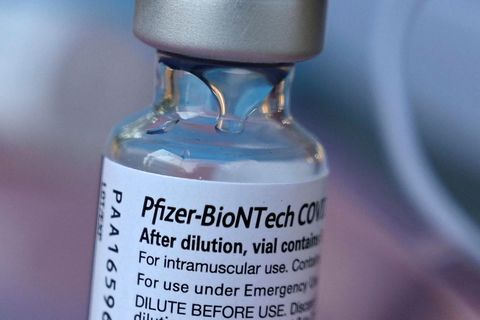
Lyfjaframleiðandinn Moderna hefur staðfest að mengaðar framleiðslulotur Covid-bóluefnis félagsins hafi ekki borist til Íslands. Þær hafi eingöngu farið í dreifingu í Japan en ekki á Evrópumarkaði. Lyfjastofnun Evrópu hefur kallað eftir upplýsingum frá markaðsleyfihafa lyfsins, þar á meðal um upplýsingar um hvernig aðskotaefnið barst í bóluefnið.
Þetta kemur fram í skriflegu svari Lyfjastofnunar við fyrirspurn mbl.is. Lyfjastofnun hefur heyrt af málinu og segir Lyfjastofnun Evrópu fylgjast náið með framvindu þess. Nánari upplýsingar um málið muni berast þaðan.
Hafa áður stöðvað notkun lyfja
Lyfjastofnun hefur áður kallað inn lyf vegna gallaðra lotna lyfja eða lotna sem ekki uppfylla ströngustu gæðaskilyrði. Það fari þá eftir alvarleika málsins og áhættumati til hvaða aðgerða sé gripið til.
„Þegar upp koma gæðafrávik eða galli í markaðssettum lyfjum er metið í samráði við markaðsleyfishafa hvort fram þurfi að fara innköllun á lyfinu út frá áhættumati. Einnig er samhliða krafa á markaðsleyfishafann að framvísa gögnum og láta fara fram rótargreiningu á hvað orsakaði frávikið eða gallann.“
Moderna-bóluefnið heitir Spikevax og hefur meðal annars verið nota í örvunarskammta síðustu misseri.
AFP
Kanna ekki einstakar lotur
Lyfjastofnun skoðar að jafnaði ekki sjálf einstakar lotu lyfja en í tilfelli líftæknilyfja, á borð við bóluefni, er samstarf á vegum lyfjaeftirlitsaðila í Evrópu um að sjá um prófanir á lotum lyfjanna. Þá skipta opinberar lyfjarannsóknarstofur með sér verkum og framkvæma gæðaprófanir á öllum framleiðslulotum.
Komi upp gæðafrávik eða galli í markaðssettum lyfjum er það metið í samráði við markaðsleyfishafa hvort þörf sé á að innkalla lyfið. Þá er samhliða krafa á markaðsleyfishafa að framvísa gögnum og láta fara fram rótargreiningu á hvað hafi orsakað frávikið.
Afleiðingarnar mismunandi
„Lyfjayfirvöld meta síðan hvort framleiðsluaðili haldi vottun sinni og framleiðsluleyfi, allt eftir eðli máls. Í sumum tilvikum er gefin út yfirlýsing tímabundið að framleiðsla frá viðkomandi framleiðanda uppfylli ekki gæðastaðla og út frá því þarf sami aðili að sýna fram á að viðeigandi ráðstafanir hafi verið gerðar sem tryggi gæði framleiðslunnar samkvæmt stöðlum.
Í því getur falist gæðaúttekt sem eftirlitsmenn lyfjastofnana annast. Í mörgum tilvikum er augljóst hvert vandamálið er og úrbætur því einfaldar. Einstaka sinnum er um stærri og almennari vandamál að ræða sem leiða til þess að framleiðandi missir framleiðsluleyfi,“ segir í svari stofnunarinnar.







 Von á talsverðu hríðarveðri: Vegir munu teppast
Von á talsverðu hríðarveðri: Vegir munu teppast
 Hefja undirbúning verkfalla
Hefja undirbúning verkfalla
 Fagnar brú sem hann áður gagnrýndi
Fagnar brú sem hann áður gagnrýndi
 Áfram mælast skjálftar á miklu dýpi
Áfram mælast skjálftar á miklu dýpi
 Hæstiréttur staðfestir TikTok-bann
Hæstiréttur staðfestir TikTok-bann
 Öryggisráð Ísraels samþykkir vopnahlé
Öryggisráð Ísraels samþykkir vopnahlé